センター試験科学対策として、ここでは原子の構造や同位体についてポイントを整理しています。
スポンサーリンク
陽子の数=電子の数=原子番号
元素記号Na(ナトリウム)は、原子番号11であるので、陽子の数も電子の数も11個です。このことは、原子番号11を使って、11Na と表現することができます。
また、質量数を左上に記すことで、次のように原子の構造を表現することができます。
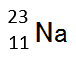
原子の構造
陽子の数+中性子の数=質量数
- 上記の原子の構造から、Na の中性子の数は、23-11=12 であることがわかります。
- 質量数1、原子番号1の水素(H)原子の中性子は0となります。
- 陽子と中性子の質量は大体同じで、電子の質量の1840倍あります。このように電子の質量は非常に小さいので、原子の質量は、陽子と中性子の数の和である質量数によって決まると言って差し支えありません。
同位体
同位体は、原子番号、陽子の数、元素が同じで、質量数、中性子の数、質量が異なります。そして、同位体の化学的な性質は、ほとんど同じです。
化学的性質は電子の数で決まります。同位体は電子の数が同じなので、同位体の化学的性質は同じになります。
同位体は電子の数は同じでも中性子の数は異なります。
また、各元素の同位体の天然における存在率は一定です。
例えば、炭素(C)の場合、12Cは98.9%、13Cは1.1%です。ちなみに、炭素というとよくわからない物質のイメージになるかもしれないですが、タイヤモンドも炭素(C)です。
ダイヤ欲しいです。現金に換金したいです。ウフフフフフフ。
例題
ある原子には、AとBとの2つの同位体があり、Bの原子番号はZで、AとBの質量数の和は2aになり、Aの質量数はBの質量数より2bだけ大きい。A原子の原子核中の中性子の数を、a、b、Zを使って示せ。
解説
A, B の質量数をそれぞれ、x, y とすると、次式が成り立ちます。
x + y = 2a ・・・①
x – y = 2b ・・・②
①+②より、2x = 2a + 2b, よって、 x = a + b
「原子番号=陽子の数」、「質量数=陽子の数+中性子の数」より、
中性子の数=質量数ー陽子の数= x – Z = a + b – Z