ここでは、大学受験対策用に固体の溶解度についてポイントを解説していきます。受験前の整理にも活用できます(多分)。
スポンサーリンク
固体の溶解度
固体の溶解度とは、溶媒100gに溶けることができる溶質のグラム[g]数です。溶媒とか溶質とか聞きなれないかもしれませんが、「 水100gに溶けることができる塩のグラム数 」に置き換えてイメージしてみてください。
また、質量パーセント濃度とは、溶液100gに溶けている溶質のグラムの数のことを言います。
問題によっては、稀に質量パーセント濃度で溶解度を表すこともあるようです。
溶解度曲線のグラフの読み方を理解しよう(飽和水溶液)
下のグラフは物質Xの溶解度曲線です。A, B, C の各点ではどのような状態であるかを考えてみましょう。
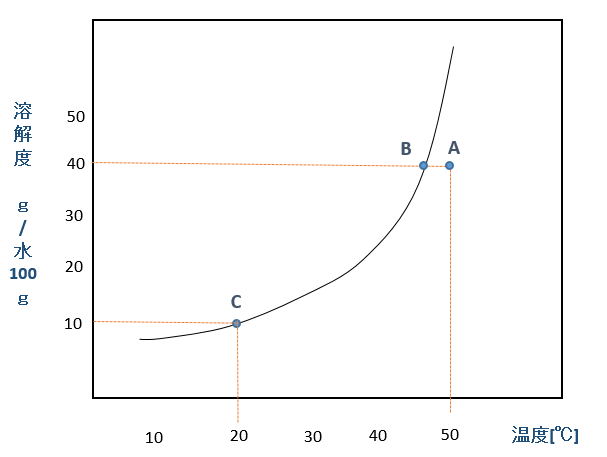
物質Xの溶解度曲線
A点:50℃の水100gにXが40g溶けている状態です。まだ、溶ける余裕がある状態で、不飽和水溶液です。
B点:A点の水が冷えて40℃になると、飽和水溶液となります。
C点:B点の水が冷えて20℃になると、飽和水溶液ですが、(40-10)=30g の物質Xの結晶が析出します。
飽和水溶液の状態では、溶質が溶け込む速さと析出する速さが等しい状態で、見かけ上、溶解・析出が停止しているようにみえ、溶液平衡の状態となります。
飽和水溶液に冷却による析出量の計算
飽和水溶液からの物質の析出量の計算は次の比例計算がポイントです。
飽和水溶液W[g]を冷却したとき析出した結晶x[g]
(100+はじめの溶解度):(溶解度の差)=W:x
飽和水溶液の水の蒸発による析出量の計算
次は、冷却ではなく、水が蒸発したときの析出量の計算です。この場合も比例計算で求めます。
飽和水溶液の水W[g]を蒸発させたときに析出した結晶x[g]
100:溶解度=W:x
温度 t [℃] の水に対する物質Aの溶解度Sにおいて、t [℃]のAの飽和水溶液の水W[g]蒸発させたときに析出するAをx[g]とすると、『 100:S=W:x 』 の比例式となります。
(未来の)受験生の皆さん、冬の富山の海でも見て、気合い入れて勉強してください。ではでは。

富山の冬の海