ここでは、次の4種類の結晶についてポイントをまとめて整理しています。しっかり覚えて得点アップを目指しましょう。
スポンサーリンク
結晶の種類と概要
それぞれの結晶について概要を下表にまとめて掲載しています。
| 結晶の種類 | 成分元素 | 化学結合など | 特性 |
|---|---|---|---|
| イオン結晶 | 金属元素・非金属元素 | イオン結合 | 電導性が結晶状態ではないが、加熱融解するとある |
| 分子結晶 | 非金属元素 | 分子間力、水素結合 | 融点が低い |
| 共有結合の結晶 | C、Si、SiO2 | 共有結合 | 融点が非常に高い |
| 金属結晶 | 金属元素 | 金属結合 | 光沢、展性・延性、電導性 |
イオン結晶
イオン結晶は加熱融解したり、水溶液にするなどイオンが移動できるようにすると電気を導くようになります、ただし、NH4C は例外で、非金属元素のみからなるイオン結晶です(テストによく出ますよ!)。
分子結晶
分子結晶の分を子構成する原子間の結合は共有結合です。分子間に水素結合を形成するのは、H2O、HF、NH3、およびアルコールやカルボン酸の結晶です。
共有結合の結晶
共有結合で試験に出題されるのは、C、Si、SiO2の3つでしょう。C はダイヤモンドと黒鉛、SiO2は石英、水晶、ケイ砂などです。
| 比較 | ダイヤモンド | 黒鉛(グラファイト) |
|---|---|---|
| 結合 | 4個の価電子がすべて共有結合
正四面体構造 |
3個の価電子が共有結合
平面構造、平面間は分子間力 |
| 状態 | 無色透明 | 黒色不透明 |
| 硬さ | 非常に硬い(物質中最も硬い)カッチカチやぞ~ | やわらかい |
| 電導性 | 電気を通さない | 電気を通す |
金属結晶
金属結晶の「光沢、展性・延性、電導性」の3つの特性は、いずれも自由電子による性質です。
| 金属の結晶 | 体心立方格子 | 面心立方格子 | 六方最密構造 |
| 構造 | 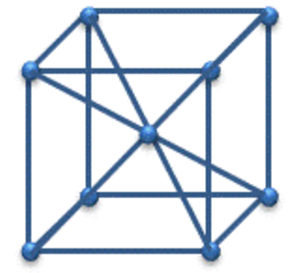 |
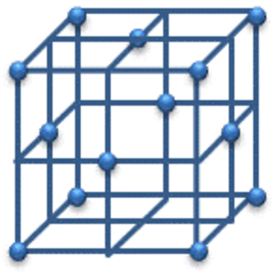 |
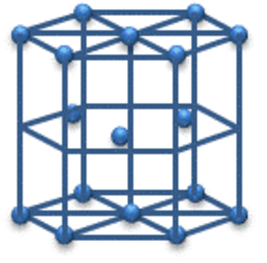 |
| 配位数 | 8 | 12 | 12 |
| 単位格子中の原子数 | 2 | 4 | 2 |
| 充填度 | 68% | 74% | 74% |
配位数:1つの原子球に接している原子球の数
重点度:原子を球と考えた時、球の詰まっている割合
単位格子中の原子数の数え方
単位格子の立方体の8個の頂点は8つの単位格子に属しているから、頂点の単位格子の原子数は1/8 × 8 = 1個です。
体心立方格子:中心に1個の原子があるから、1 + 1 = 2個
面心立方格子:面の原子は2つの単位格子に属していて、面は6個あるから 1 / 2 × 6 = 3個なので、1 + 3 = 4個